
疫苗是控制和根除傳染病最有(yǒu)效的方法,而mRNA疫苗憑借其獨特的優勢獨領風騷。首先,mRNA是一種能(néng)夠編碼大量抗原的非感染性和非整合性物(wù)質(zhì)。其次,mRNA 疫苗可(kě)以結合不同抗原 的mRNAs;例如巨細胞病毒疫苗可(kě)以含有(yǒu)5個獨立編碼的五聚體(tǐ)抗原和1個編碼糖蛋白抗原。最後,與重組蛋白和滅活疫苗等其他(tā)疫苗平台相比,可(kě)以迅速為(wèi)特定抗原制備 GMP 級脂質(zhì)納米粒mRNA 疫苗。這些優點将促使脂質(zhì)納米粒mRNA 制劑成為(wèi)靈活的、剛需的疫苗平台,以對抗新(xīn)出現的傳染病病原作(zuò)出快速免疫反應。目前臨床前和臨床試驗使用(yòng)的大多(duō)數mRNA疫苗均以單次肌肉注射給藥的形式進行免疫,經免疫或非免疫細胞吸收并轉化為(wèi)抗原,遞呈給T細胞和B細胞從而啓動免疫應答(dá)(圖1)。首個于1993年設計的mRNA 疫苗由脂質(zhì)體(tǐ)和編碼流感病毒核蛋白的mRNA 制成的,能(néng)夠在小(xiǎo)鼠體(tǐ)内誘導較強的病毒特異性細胞毒性T細胞反應。
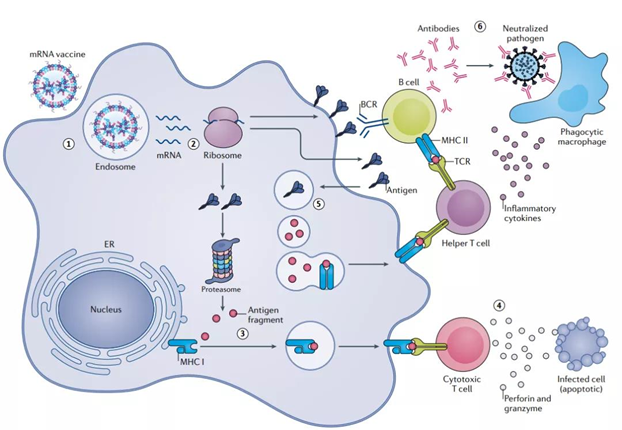
圖1 :mRNA疫苗在細胞中(zhōng)誘導免疫保護反應的模式圖
脂質(zhì)納米粒mRNA處方的特點在臨床前和臨床上都得到了深入的研究,這使得新(xīn)型冠狀病毒肺炎脂質(zhì)納米粒mRNA 疫苗得以迅速開發和臨床應用(yòng)。例如,SARS COV-2基因組序列獲得後一個月内完成COVID-19疫苗mRNA-1273的生産(chǎn),又(yòu)經約1、4和5個月的時間,分(fēn)别啓動了I、 II和 III期臨床試驗 。最後,mRNA-1273在一年内獲得FDA緊急使用(yòng)授權和EMA條件性市場授權。這一快捷的授權審批使我們颠覆了對新(xīn)藥申請一般比較漫長(cháng)的認知。
随着第一款COVID-19疫苗,mRNA-1273的授權緊急使用(yòng),mRNA疫苗的研發、生産(chǎn)都進入了飛速跨越的階段。截至2019年底,共有(yǒu)24種針對傳染病的候選mRNA疫苗已進入臨床試驗階段。目前已經開展了一系列針對新(xīn)冠病毒、多(duō)種流感病毒、狂犬病毒、巨細胞病毒、寨卡病毒、人類偏肺病毒聯合副流感病毒、人類呼吸道合胞病毒和基孔肯雅病毒等mRNA 疫苗的臨床試驗(表1)。 此外,基于脂質(zhì)納米粒子為(wèi)載體(tǐ)的 mRNA疫苗已在動物(wù)模型上進行其他(tā)病毒的試驗,包括人類免疫缺陷病毒,powassan病毒,委内瑞拉馬腦炎病毒,登革熱病毒和埃博拉病毒,同時還有(yǒu)針對對抗寄生蟲和細菌感染的mRNA疫苗的動物(wù)試驗。這些動物(wù)試驗的結果,均顯示出較強的免疫反應,為(wèi)後續的臨床研究提供強有(yǒu)力的理(lǐ)論依據。讓人激動人心的是2021年8月23日輝瑞公(gōng)司(Pfizer Inc.)和合作(zuò)夥伴BioNTech SE 的新(xīn)冠疫苗終于獲得了美國(guó)監管機構的全面批準,這将确保疫苗能(néng)盡快地供應給亟需的群體(tǐ)。
綜上所述,針對各種病原微生物(wù)引起的傳染病,mRNA疫苗展示出巨大的防治潛力。
表1:脂質(zhì)納米粒mRNA 疫苗抗感染的臨床試驗
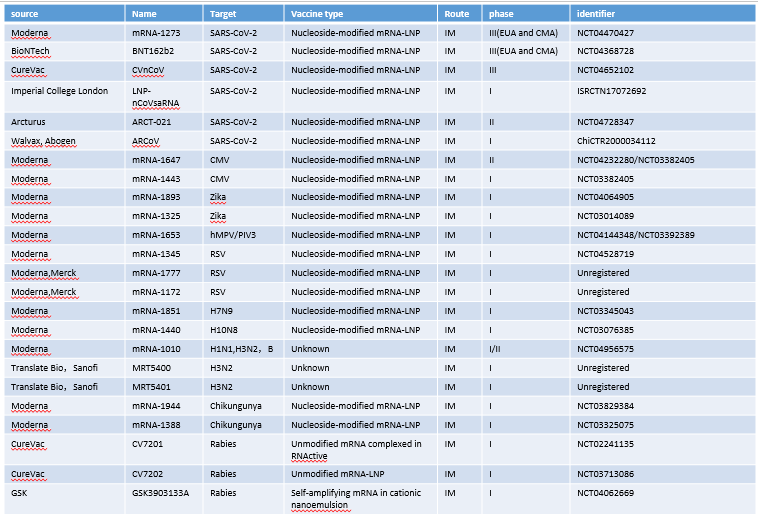
信息來源于Nat Rev Mater. 2021 Aug 10:1-17. doi: 10.1038/s41578-021-00358-0;生物(wù)制品圈;抗體(tǐ)圈